Em 1904, o cientista neozelandês Ernest Rutherford realizou um experimento que ficou conhecido na história da ciência como experimento de Rutherford. Ele já sabia da existência das partículas de carga positiva, denominadas partículas alfa (
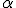 ). Em seu experimento, Rutherford colocou no interior de um bloco de chumbo uma substância emissora de partículas
). Em seu experimento, Rutherford colocou no interior de um bloco de chumbo uma substância emissora de partículas 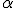 , de forma que elas fossem orientadas, por meio de um orifício em uma placa de chumbo, a colidir contra uma fina lâmina de ouro.
, de forma que elas fossem orientadas, por meio de um orifício em uma placa de chumbo, a colidir contra uma fina lâmina de ouro.Observe o esquema do experimento de Rutherford:
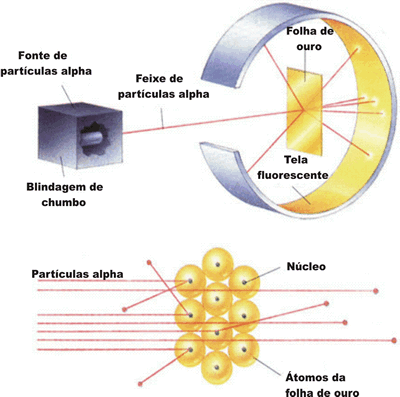
Com esse experimento, ele verificou que:
a maioria das partículas
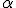 atravessa a lâmina de ouro;
atravessa a lâmina de ouro;algumas dessas partículas, ao atravessar a lâmina, eram desviadas;
uma pequena parte das partículas
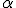 não ultrapassa a lâmina e retornava, como se essas partículas se chocassem com algo muito denso.
não ultrapassa a lâmina e retornava, como se essas partículas se chocassem com algo muito denso.Analisando esses resultados, Rutherford concluiu que:
O átomo não é uma esfera maciça. Existem grandes espaços vazios visto que a maior parte das partículas
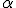 atravessou a lâmina de ouro.
atravessou a lâmina de ouro.O átomo possui uma região central onde está concentrada a sua massa. Foi contra essa região, denominada por ele de núcleo, que as partículas
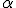 , se chocaram e retornaram.
, se chocaram e retornaram.Esse núcleo apresenta carga positiva, pois repeliu a partícula
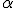 - que também possui carga positiva.
- que também possui carga positiva.Com esses dados, Rutherford construiu um modelo atômico semelhante ao Sistema Solar, em que o átomo é uma partícula muitíssimo pequena composta de duas regiões:
uma interna, o núcleo, onde estariam concentradas praticamente toda a massa do átomo – de carga elétrica positiva, representada por partículas chamadas de prótons;
outra externa, de massa desprezível, onde estariam os elétrons, diminutas partículas negativas em movimento ao redor do núcleo.
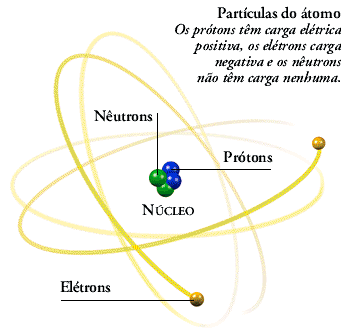
Nos modelos aqui apresentados, as dimensões do núcleo e da eletrosfera não estão em escala. Na realidade, a eletrosfera tem o seu volume cerca de 100 mil vezes maior que o do núcleo.
Em 1932, o físico inglês James Chadwick (1891-1974), realizando experiências com material radioativo, comprovou uma das hipóteses de Rutherford que afirmava a possibilidade de existir no núcleo uma outra partícula desprovida de carga elétrica.
Chadwick chamou essas partículas de nêutrons.
O modelo de Rutherford-Böhr
O modelo atômico de Rutherford foi complementado com um novo conceito introduzido pelo físico dinamarquês Niels Bohr:
“O elétrons descreve uma órbita circular ao redor do núcleo sem ganhar ou perder energia.”
Cada órbita descrita pelo elétron é denominada nível de energia ou camada de energia. Em um átomo, há várias órbitas circulares, cada uma delas com um determinado valor energético.
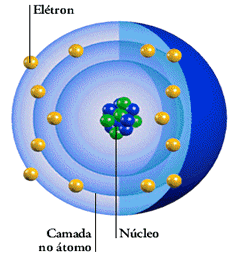
Outros modelos que vieram depois especificam as características das órbitas ou camadas de energia, incorporando a discussão de elétron considerado como partícula e/ou onda.
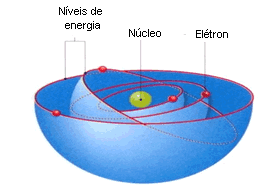
Pesquisas mais recentes, realizadas após a elaboração do modelo de Rutherford-Böhr, comprovaram que impossível determinar num mesmo instante a posição e a velocidade de um elétron. Por isso, cientistas afirmam que existe a probabilidade de os elétrons estarem em uma ou outra região da eletrosfera.
Conceito do modelo atômico de Rutherford:
Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.



.jpg)
Nenhum comentário:
Postar um comentário